Để tăng cường các ứng dụng lâm sàng của liposome, các nhà nghiên cứu đã chức năng hóa liposome theo những cách cụ thể. Các loại phổ biến bao gồm liposome tuần hoàn dài, liposome nhắm mục tiêu tích cực, liposome phản ứng với kích thích và liposome phủ màng tế bào.
1. Chức năng hoá liposome là gì?
Chức năng hóa liposome là quá trình gắn thêm các phân tử hoặc nhóm chức năng đặc biệt lên bề mặt của liposome. Quá trình này giống như việc “độ” thêm các thiết bị vào một chiếc xe, giúp chiếc xe có thêm những khả năng mới.
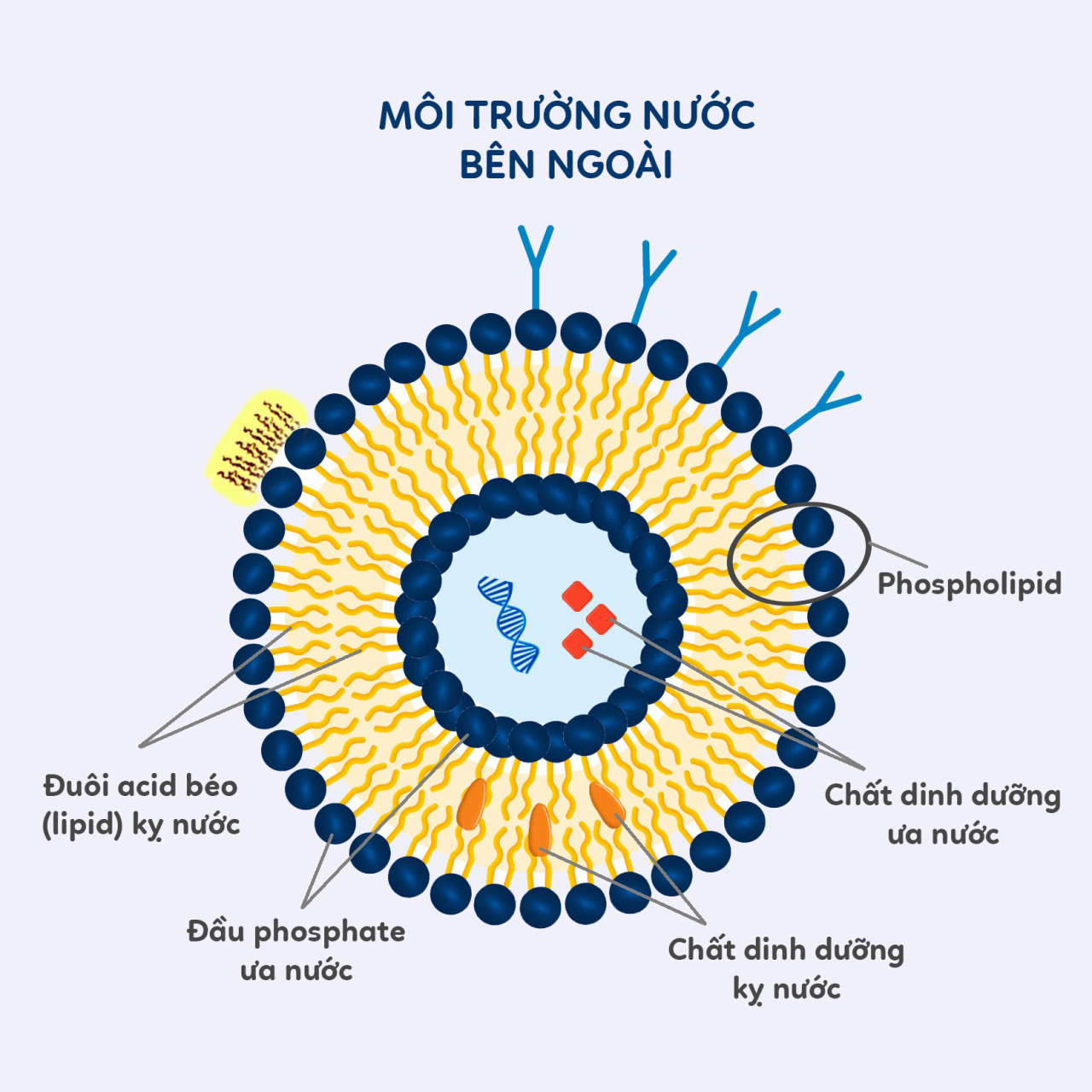
2. Phân loại chức năng hoá liposome:
Trong ứng dụng chức năng hoá liposome nhằm tăng hiệu quả điều trị các bệnh ung thư, các nhà khoa học phân thành những loại phổ biến như sau:
2.1. Liposome tuần hoàn dài
Liposome tuần hoàn dài là những hạt nano được thiết kế đặc biệt để lưu thông trong máu trong thời gian dài hơn so với các liposome thông thường. Điều này giúp tăng cường hiệu quả điều trị bằng cách cho phép thuốc được vận chuyển đến đích một cách chính xác và kéo dài thời gian tiếp xúc của thuốc với mô bệnh.
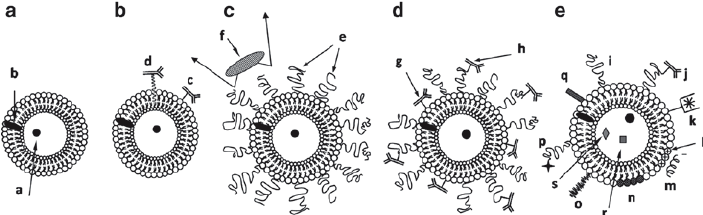
2.2. Liposome nhắm mục tiêu chủ động
Nhiều chất mang nano liposome đã được chấp thuận để cung cấp thuốc chống khối u theo cách nhắm mục tiêu thụ động. Tuy nhiên, nhắm mục tiêu thụ động không phân biệt giữa tế bào bình thường và tế bào bệnh. Do đó, liposome nhắm mục tiêu đã được phát triển để tăng khả năng định vị và tích tụ thuốc liposome trong mô khối u.
Liposome nhắm mục tiêu chủ động có thể cải thiện hiệu quả của thuốc và giảm tác dụng phụ thông qua hai chiến lược: bằng cách nhắm mục tiêu vào các thụ thể bề mặt biểu hiện quá mức của tế bào ung thư và bằng cách nhắm mục tiêu vào vi môi trường khối u (TME). Các phối tử cho liposome nhắm mục tiêu chủ động bao gồm kháng thể, protein, peptide, vitamin, yếu tố tăng trưởng, aptamer, v.v.
2.2.1. Biến đổi bề mặt của liposome bằng kháng thể
Biến đổi bề mặt của liposome bằng kháng thể là một kỹ thuật quan trọng trong y học, đặc biệt là trong lĩnh vực điều trị ung thư. Bằng cách gắn các kháng thể đặc hiệu lên bề mặt liposome, chúng ta tạo ra những hạt nano thông minh, có khả năng nhắm mục tiêu vào các tế bào ung thư mang kháng nguyên tương ứng, giúp tăng cường hiệu quả điều trị và giảm thiểu tác dụng phụ.
2.2.2. Biến đổi bề mặt của Liposome bằng Axit Folic
Axit folic, một loại vitamin B9, được biết đến với vai trò quan trọng trong quá trình tổng hợp DNA và phân chia tế bào. Đặc biệt, các tế bào ung thư thường có nhu cầu về axit folic cao hơn so với các tế bào bình thường để duy trì quá trình tăng sinh nhanh chóng. Do đó, việc biến đổi bề mặt của liposome bằng axit folic là một chiến lược thông minh để nhắm mục tiêu vào các tế bào ung thư.
Cơ chế hoạt động của phương pháp biến đổi bề mặt của liposome bằng Axit Folic:
2.2.3. Biến đổi bề mặt của Liposome bằng Transferrin (Tf)
Transferrin (Tf) là một protein vận chuyển sắt trong máu. Các tế bào đang phân chia, đặc biệt là tế bào ung thư, thường có nhu cầu về sắt cao hơn so với các tế bào bình thường. Do đó, việc biến đổi bề mặt của liposome bằng Tf sẽ giúp các hạt nano này “ngụy trang” thành các phân tử sắt, dễ dàng được các tế bào ung thư hấp thụ.
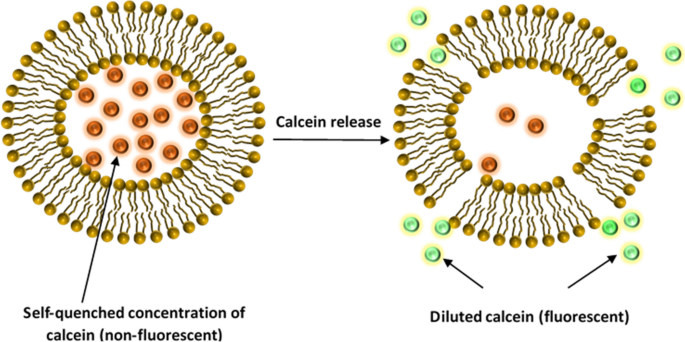
2.2.4. Biến đổi bề mặt của Liposome bằng Peptide
Peptide là những chuỗi ngắn các axit amin, là những “viên gạch” xây dựng nên protein. Nhờ vào tính đa dạng về cấu trúc và chức năng, peptide được ứng dụng rộng rãi trong việc chức năng hóa liposome.
2.2.5. Biến đổi bề mặt của Liposome bằng Aptamer
Aptamer là DNA hoặc RNA mạch đơn ngắn có thể liên kết đặc hiệu với các mục tiêu tương ứng như protein và tế bào thông qua mô hình ba chiều độc đáo của chúng. Aptamer đã được chứng minh là công cụ mới vượt trội và nhanh nhất để nhắm mục tiêu hiệu quả vào các dấu ấn sinh học ung thư và được sử dụng làm chất phối tử hiệu quả để phân phối thuốc và liệu pháp chống ung thư.
Aptamer sở hữu một số lợi thế nội tại, bao gồm tổng hợp dễ dàng, sửa đổi thuận tiện, khả năng lập trình cao và khả năng tương thích sinh học tốt.
2.2.6. Nhắm mục tiêu vào TME
TME (Microenvironment Tumor) hay vi môi trường khối u là một hệ sinh thái phức tạp bao quanh khối u, bao gồm các tế bào ung thư, tế bào miễn dịch, mạch máu mới hình thành, ma trận ngoại bào và các phân tử tín hiệu. Vi môi trường này đóng vai trò quan trọng trong quá trình phát triển, xâm lấn và kháng thuốc của khối u.
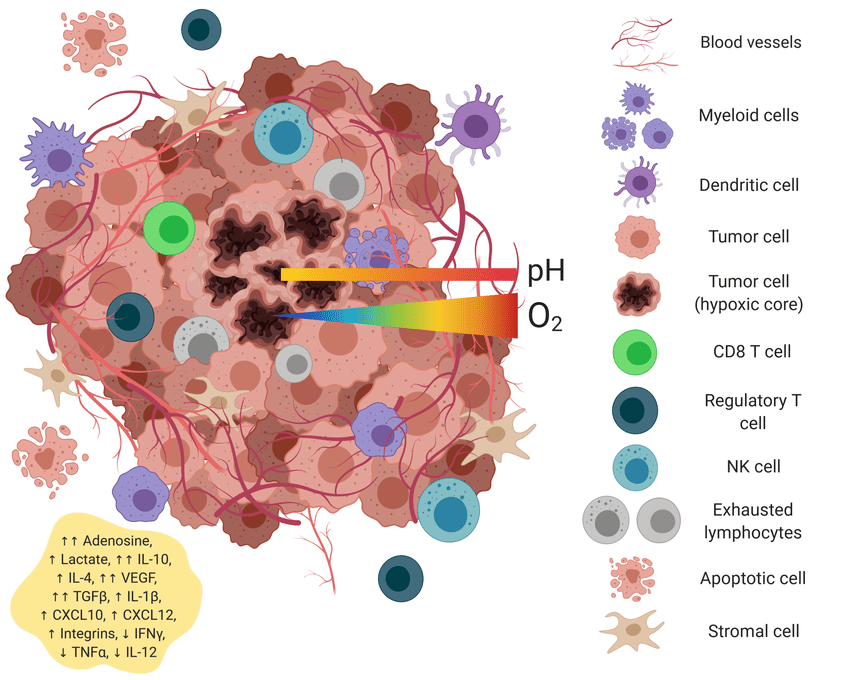
Cho nên, ngoài việc nhắm mục tiêu vào các thụ thể bề mặt tế bào ung thư, nhắm mục tiêu hoạt động đặc hiệu vào khối u cũng có thể nhắm mục tiêu vào TME là một phương pháp rất hiệu quả trong việc ứng dụng công nghệ liposome trong điều trị ung thư. Nanomedicine có thể được sử dụng để nhắm mục tiêu vào các dấu hiệu phân tử đặc hiệu TME như các thành phần của ma trận ngoại bào, các tình huống bệnh lý sinh lý đặc hiệu khối u và các enzym đặc hiệu TME. Liposome có thể ngăn chặn sự khuếch tán của khối u bằng cách nhắm mục tiêu vào mạch máu khối u. Nhắm mục tiêu TME bằng các phối tử hóa học cho thấy tiềm năng lớn trong việc cải thiện hiệu quả nhắm mục tiêu của việc cung cấp thuốc và hiệu quả của liệu pháp điều trị ung thư do nhiều đặc điểm độc đáo của các thành phần TME.
2.3. Liposome phản ứng với kích thích
Phản ứng của liposome với kích thích là một đặc tính quan trọng, cho phép chúng giải phóng thuốc một cách có kiểm soát tại vị trí bệnh lý. Dưới đây là một số cách mà liposome có thể phản ứng với kích thích:
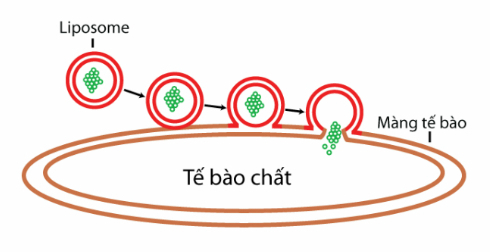
2.4. Liposome phủ màng tế bào
Liposome phủ màng tế bào là một công nghệ mới nổi trong lĩnh vực y dược, đặc biệt là trong việc vận chuyển thuốc và liệu pháp gen. Ý tưởng chính là tạo ra các hạt nano liposome có lớp vỏ ngoài giống hệt màng tế bào, giúp chúng dễ dàng “lẩn trốn” hệ thống miễn dịch từ đó có thể kéo dài thời gian lưu thông máu và tăng cường phân phối thuốc có mục tiêu.
Hiện nay, nhiều loại màng đã được sử dụng để chế tạo nanoliposome mô phỏng sinh học để điều trị ung thư, bao gồm màng cho tế bào hồng cầu (RBC), bạch cầu, tiểu cầu, tế bào ung thư, vi khuẩn, tế bào gốc, v.v. Liposome có nhiều chức năng khác nhau tùy thuộc vào loại màng tế bào.
2.4.1. Liposome phủ màng RBC
Năm 2011, công nghệ phủ màng tế bào sử dụng màng RBC làm vật liệu màng đã được báo cáo lần đầu tiên. RBC, loại tế bào có nhiều nhất trong máu, chủ yếu chịu trách nhiệm vận chuyển oxy trong cơ thể và có tuổi thọ lên đến 120 ngày ở người. Công nghệ này ức chế sự tấn công của hệ thống miễn dịch để kéo dài thời gian lưu thông máu, thông qua các dấu hiệu bao gồm các phân tử CD47 trên bề mặt của RBC và một loạt các protein điều hòa bổ sung. Liposome phủ màng RBC thể hiện sự phân bố kích thước phù hợp và độ ổn định cao, dẫn đến thời gian lưu thông tốt hơn so với liposome PEGylated thông thường.
2.4.2. Liposome phủ màng bạch cầu
Liposome phủ màng bạch cầu là một công nghệ mới nổi, kết hợp ưu điểm của liposome (vận chuyển thuốc hiệu quả) với khả năng ngụy trang của màng bạch cầu. Bằng cách bao phủ liposome bằng một lớp màng tế bào bạch cầu, các hạt nano này có thể “giả dạng” thành tế bào bạch cầu, qua đó dễ dàng xâm nhập vào các mô và tế bào đích, đặc biệt là các vùng viêm nhiễm hoặc khối u.
Bạch cầu, bao gồm nhiều phân nhóm đa dạng bao gồm bạch cầu trung tính, tế bào dendrit, đại thực bào, bạch cầu ái toan, tế bào lympho và các loại khác, là một thành phần chính khác của tế bào trong quá trình lưu thông máu. Bạch cầu trú ngụ tại các vị trí tổn thương, xâm nhập vào hệ thống mạch máu, trốn tránh sự thanh thải miễn dịch và nhắm mục tiêu vào các tế bào ung thư di căn thông qua tương tác của các integrin VCAM-1-α4. Do đó, các liposome phủ màng bạch cầu thường được đề xuất để cung cấp thuốc điều trị ung thư.
2.4.3. Liposome phủ màng tiểu cầu
Tiểu cầu là mảnh vụn tế bào tách ra khỏi tế bào chất của đại thực bào trưởng thành trong tủy xương của cơ thể. Trong hệ thống tuần hoàn máu, tiểu cầu chủ yếu đóng vai trò cầm máu và đông máu, hỗ trợ dinh dưỡng và sửa chữa nội mô mạch máu. Ngoài ra, tiểu cầu còn đóng vai trò quan trọng trong việc điều hòa khả năng miễn dịch của vật chủ và phản ứng viêm của cơ thể. Vì màng tiểu cầu có thụ thể CD47 nên nó có khả năng thoát khỏi thực bào trong tuần hoàn toàn thân. Ngoài ra, màng tiểu cầu bám chọn lọc vào mạch máu của các vị trí bệnh và cũng có thể tập hợp đặc hiệu xung quanh các tế bào khối u tuần hoàn thông qua thụ thể chọn lọc P và CD44
2.4.4. Liposome phủ màng tế bào ung thư
Công nghệ phủ tế bào có thể áp dụng cho màng tế bào ung thư cũng như tế bào có nguồn gốc từ máu. Trong những năm gần đây, các nhà khoa học cũng đã sử dụng màng tế bào ung thư làm màng sinh học để bọc các hạt nano. Tế bào ung thư có một đặc điểm vốn có cho phép chúng bám vào nhau, khiến khối u phát triển vô thời hạn. Tế bào ung thư có nhiều kháng nguyên liên quan đến khối u trên bề mặt của chúng, cho phép chúng nhắm mục tiêu vào các vị trí khối u cụ thể thông qua liên kết đồng loại nội tại. Có thể đưa kháng nguyên khối u đến vị trí khối u bằng cách sử dụng liposome phủ màng tế bào ung thư đã trải qua quá trình xử lý trong ống nghiệm. Điều này sẽ kích hoạt phản ứng miễn dịch bẩm sinh, giúp tiêu diệt các tế bào ung thư.
3d render of a medical background with close up of virus cells and DNA strand
2.4.5. Liposome phủ màng tế bào gốc
Trong quá trình biệt hóa đa dòng, tế bào gốc có khả năng tự sao chép rất lớn. Ở các giai đoạn phát triển khác nhau, tế bào gốc có tác động mục tiêu hoạt động tự nhiên lên các khối u rắn. Do đó, việc phủ màng tế bào gốc lên các hạt nano giúp có thể chế tạo các chất mang nano có chức năng nhắm mục tiêu tương tự.
2.4.6. Liposome phủ màng tế bào lai
Liposome phủ màng tế bào lai là một khái niệm mở rộng dựa trên ý tưởng kết hợp các đặc tính tốt nhất của liposome và màng tế bào. Nếu như liposome phủ màng tế bào truyền thống thường sử dụng một loại màng tế bào duy nhất, thì liposome phủ màng tế bào lai lại kết hợp nhiều loại màng tế bào khác nhau hoặc thậm chí kết hợp với các thành phần khác để tạo ra một lớp vỏ ngoài phức tạp hơn.
Đôi khi, người ta cũng mong muốn kết hợp các chức năng của nhiều loại tế bào thành một hạt nano, nghĩa là tích hợp hai màng sinh học khác nhau để bao bọc các hạt nano và tối đa hóa chức năng. Theo nghiên cứu, lớp phủ lõi hoặc sự tích hợp của các chất mang nano liposome không ảnh hưởng đến các đặc tính riêng biệt của các màng tế bào khác nhau. Để tăng độ hòa tan và nhắm mục tiêu, một hệ thống phân phối dựa trên liposome đã được ngụy trang bằng màng tế bào lai (màng hồng cầu và màng tế bào ung thư). Liposome màng lai có thời gian bán hủy kéo dài, khả năng trốn tránh miễn dịch tăng lên và khả năng nhắm mục tiêu tại vị trí khối u cũng như hoạt động chống khối u tốt mà không có tác dụng phụ đối với mô bình thường
Nói tóm lại, Chức năng hóa Liposome chính là hướng đi đột phá trong hiện tại và tương lai cho phát triển công nghệ y học hướng tới điều trị nhiều căn bệnh nan y của thời đại. Công nghệ này mở xa hy vọng cho nhiều bệnh nhân trong tương lai, đồng thời cũng là bài toán thách thức cho nhiều công ty dược phẩm chạy đua trong cuộc cách mạng công nghệ của thế kỷ 21 này.